¿Cuál es la diferencia entre km y vmax?
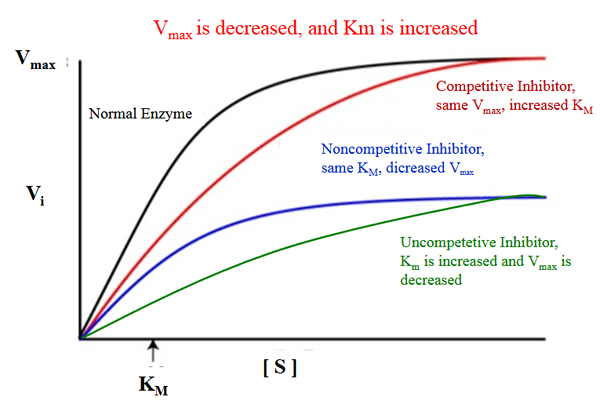
El diferencia clave entre km y vmax es que KM mide la facilidad con qué facilidad una enzima puede ser saturada por el sustrato, mientras que Vmax es la velocidad máxima a la que se cataliza una enzima cuando la enzima está saturada por el sustrato.
KM puede describirse como la concertación del sustrato al que se logra la mitad de la velocidad máxima. Vmax, por otro lado, puede describirse como la velocidad de reacción en el estado donde la enzima está completamente saturada por el sustrato.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es km
3. Que es vmax
4. Km vs Vmax en forma tabular
5. Resumen -Km vs Vmax
Que es km?
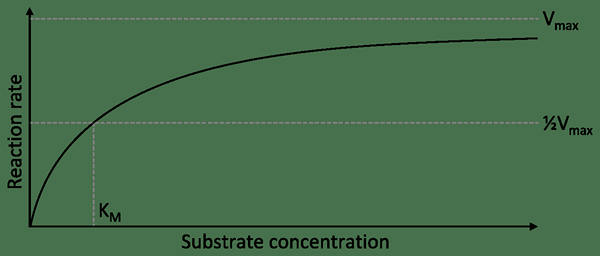
KM puede describirse como la concertación de un sustrato al que se alcanza la mitad de la velocidad máxima. En otras palabras, es la concentración de sustrato que permite que la enzima alcance la mitad de Vmax. Por lo tanto, una enzima que tiene un KM alto muestra una baja afinidad por su sustrato. También requiere una mayor concentración del sustrato para lograr Vmax.
El término km en la actividad enzimática se discute bajo la cinética de Michaelis-Menten. Es un modelo común de cinética enzimática. Este modelo lleva el nombre del bioquímico alemán Leonor Michaelis y el médico canadiense Maud Menten. Este modelo se expresa como una ecuación.
v = d [p]/dt = vmax ([s]/km+[s])
En la ecuación anterior, Vmax es la velocidad máxima alcanzada por el sistema que ocurre a la concentración de sustrato saturado para una concentración de enzima dada. Km es la constante de Michaelis. Si es numéricamente igual a la concentración del sustrato, entonces la velocidad de reacción es la mitad del valor de Vmax.
Además, a menudo se supone que las reacciones bioquímicas con un solo sustrato muestran una cinética de Michaelis-Menten sin la preocupación de cualquier suposición subyacente de este modelo.
Que es vmax?
Vmax puede describirse como la velocidad de reacción en el estado donde la enzima está completamente saturada por el sustrato. Este estado indica que todos los sitios de unión se vuelven constantemente. En otras palabras, Vmax es la velocidad de reacción máxima o la velocidad de una reacción que se cataliza enzimáticamente sobre la saturación de la enzima con su sustrato.

Es importante determinar el KM y VMAX para una cierta actividad enzimática porque saber estos valores nos permite predecir el destino metabólico del sustrato y la cantidad relativa de sustrato que pasará por cada vía en diferentes condiciones. Un valor más bajo de VMAX indica que la enzima está funcionando en condiciones subóptimas.
¿Cuál es la diferencia entre km y vmax??
Los términos km y vmax son importantes en la cinética enzimática. La diferencia clave entre KM y VMAX es que KM mide la facilidad con qué facilidad la enzima puede ser saturada por el sustrato, mientras que Vmax es la velocidad máxima a la que se cataliza una enzima cuando la enzima está saturada por el sustrato.
La siguiente tabla resume la diferencia entre km y vmax.
Resumen -Km vs Vmax
KM es la concertación del sustrato al que se logra la mitad de la velocidad máxima. Vmax es la velocidad de reacción en el estado donde la enzima está completamente saturada por el sustrato. La diferencia clave entre KM y VMAX es que KM mide la facilidad con qué facilidad la enzima puede ser saturada por el sustrato, mientras que Vmax es la velocidad máxima a la que se cataliza una enzima cuando la enzima está saturada por el sustrato.
Referencia:
1. "¿Qué son los ensayos cinéticos enzimáticos?? una descripción general." Consejo de biosistemas, 20 de enero. 2022.
Imagen de cortesía:
1. "Michaelis Menten Curve 2" de Thomas Shafee - Trabajo propio (CC por 4.0) a través de Commons Wikimedia
2. "Curva de cinética enzimática" de Imrankhan1992 - Trabajo propio (CC0) a través de Commons Wikimedia


