¿Cuál es la diferencia entre el nitrato de plomo y el nitrato de zinc?
El Diferencia clave entre el nitrato de plomo y el nitrato de zinc Es que el nitrato de plomo reacciona con hidróxido de amonio, formando un precipitado blanco que no es soluble en la solución de exceso de hidróxido de amonio, mientras que el nitrato de zinc reacciona con hidróxido de amonio, formando un precipitado blanco que es soluble en la solución de exceso de hidróxido de amonio.
El nitrato de plomo es un compuesto inorgánico que tiene la fórmula química Pb (NO3) 2, mientras que el nitrato de zinc es un compuesto inorgánico que tiene la fórmula química Zn (NO3) 2.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el nitrato de plomo?
3. ¿Qué es el nitrato de zinc?
4. Nitrato de plomo vs nitrato de zinc en forma tabular
5. Resumen -Nitrato de plomo vs nitrato de zinc
¿Qué es el nitrato de plomo??
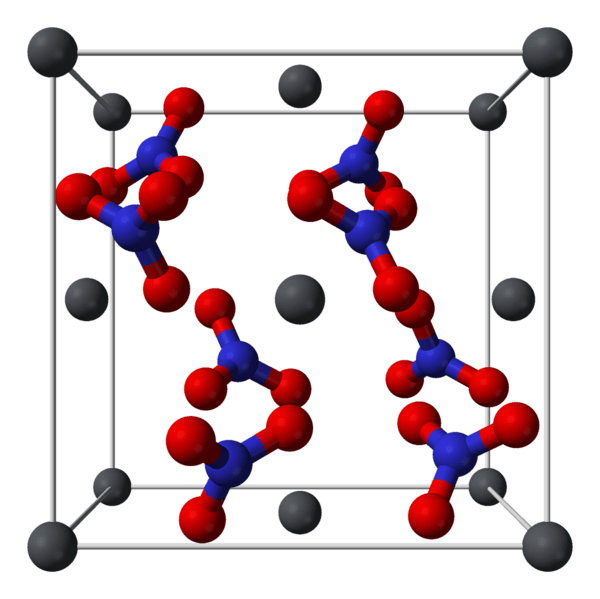
El nitrato de plomo es un compuesto inorgánico que tiene la fórmula química PB (NO3) 2. Comúnmente, existe como un cristal incoloro o un polvo blanco. Se descompone a altas temperaturas. Por lo general, este compuesto es tóxico y necesitamos manejarlo con cuidado para evitar su inhalación, ingestión y contacto de la piel.
Podemos producir compuestos de nitrato de plomo a través de la reacción entre el óxido de plomo y el ácido nítrico concentrado. Además, podemos prepararlo a partir de la evaporación de la solución obtenida por la reacción del plomo metálico con ácido nítrico diluido. Además, los cristales de nitrato de plomo pueden formarse en el procesamiento de los desechos de plomo-bismuto de las refinerías de plomo.

Figura 01: La disposición atómica del compuesto de nitrato de plomo
Por lo general, el nitrato de plomo tiende a descomponerse al calentar. Esto es útil en pirotecnia. Además, es soluble en agua y también se disuelve en ácido nítrico diluido. Si agregamos compuestos álcali a la solución, se forman nitratos básicos. Podemos usar el compuesto de nitrato de plomo para la producción de complejos de coordinación. En estos complejos, el ion de plomo es un aceptador duro y puede formar complejos fuertes combinando con ligandos donadores de electrones de nitrógeno y oxígeno. mi.gramo. Combinación de nitrato de plomo y pentaetilenglicol en presencia de acetonitrilo y formas de metanol [Pb (No3)2(EO5)] Tras la evaporación.
Existen pocas aplicaciones de nitrato de plomo, incluido su uso como estabilizador de calor en poliésteres de nylon en forma de un recubrimiento para papel fototermográfico y en rodenticidas, en el proceso de cianidad de oro para fines de lixiviación y en la preparación de isotiocianatos de ditiocarbamatos.
¿Qué es el nitrato de zinc??
El nitrato de zinc es un compuesto inorgánico que tiene la fórmula química Zn (NO3) 2. Es una sal cristalina blanca que es muy delicuente. Por lo general, podemos encontrarlo en forma hexahidratada. Además, esta sustancia es soluble tanto en agua como en alcohol.
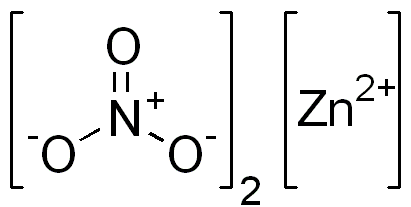
Figura 02: La estructura química del nitrato de zinc
Podemos producir nitrato de zinc disolviendo el zinc en el ácido nítrico. Sin embargo, esta reacción depende de la concentración. La reacción en ácido concentrado también forma nitrato de amonio. Además, si calentamos el compuesto de nitrato de zinc, puede sufrir una descomposición térmica para formar óxido de zinc, dióxido de nitrógeno y oxígeno.
Hay algunas aplicaciones de nitrato de zinc, que incluyen su uso en la síntesis de polímeros de coordinación, la producción de varios compuestos basados en ZnO, como un mordiente en el teñido, etc.
¿Cuál es la diferencia entre el nitrato de plomo y el nitrato de zinc??
El nitrato de plomo y el nitrato de zinc son compuestos inorgánicos que tienen aplicaciones importantes en las industrias. La diferencia clave entre el nitrato de plomo y el nitrato de zinc es su reacción con hidróxido de amonio. El nitrato de plomo reacciona con hidróxido de amonio que forma un precipitado blanco que no es soluble en la solución de exceso de hidróxido de amonio, mientras que el nitrato de zinc reacciona con hidróxido de amonio que forma un precipitado blanco que es soluble en el exceso de hidróxido de amonio.
La siguiente infografía presenta las diferencias entre el nitrato de plomo y el nitrato de zinc en forma tabular para la comparación de lado a lado.
Resumen -Nitrato de plomo vs nitrato de zinc
El nitrato de plomo y el nitrato de zinc son nitratos de los cationes con plomo y zinc, respectivamente. La diferencia clave entre el nitrato de plomo y el nitrato de zinc es que el nitrato de plomo reacciona con hidróxido de amonio que forma un precipitado blanco que no es soluble en la solución de exceso de hidróxido de amonio, mientras que el nitrato de zinc reacciona con el hidroxido de amonio que forma un precipitado blanco que es soluble en el exceso de hidroxido de amonio en el amonio que forma un precipitado blanco que es soluble en el exceso de hidroxido de amonio de amonio.
Referencia:
1."Nitrato de zinc." Centro Nacional de Información de Biotecnología. Base de datos compuesto de pubchem, U.S. Biblioteca Nacional de Medicina.
Imagen de cortesía:
1. "Balls de plomo (ii) -nitrato-Unit-Cell-3D" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Nitrato de zinc" de Edgar181 - Trabajo propio (dominio público) a través de Commons Wikimedia


