¿Cuál es la diferencia entre ácido monoprótico y diprótico?
El Diferencia clave entre ácido monoprótico y diprótico es que los ácidos monopróticos pueden donar un átomo de hidrógeno o protón a su solución acuosa, mientras que los ácidos dipróticos pueden donar dos átomos de hidrógeno o protones a su solución acuosa.
Los compuestos de ácido monoprótico y diprótico son dos grupos significativos de sustancias ácidas. Estos compuestos pueden liberar protones a sus soluciones acuosas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un ácido monoprótico?
3. ¿Qué es un ácido diprótico?
4. Ácido monoprótico vs diprótico en forma tabular
5. Resumen - ácido monoprótico vs diprótico
¿Qué es un ácido monoprótico??
Un ácido monoprótico es un ácido compuesto por un átomo de hidrógeno ionizable por molécula. Este tipo de ácido puede donar solo un protón o átomo de hidrógeno de una molécula de ácido a su solución acuosa. Por otro lado, los ácidos que pueden donar más de un protón o átomo de hidrógeno a la solución acuosa se conocen como ácidos polipróticos. Estos ácidos polipróticos se pueden clasificar aún más en grupos en función del número de protones que son donados por cada molécula. Por ejemplo, si una molécula ácida dona dos protones o átomos de hidrógeno, se conoce como ácido diprótico; Si se donan tres, se conoce como ácido triprótico, y así sucesivamente.
Por lo general, la carga eléctrica de un ácido monoprótico puede saltar a un nivel más alto antes de que pueda regalar el protón. Además, podemos predecir que cualquier ácido que tenga un átomo de hidrógeno por molécula es un ácido monoprótico. Por lo tanto, todos los ácidos de un solo hidrógeno son monopróticos. Sin embargo, no todos los ácidos monopóticos tienen solo un átomo de hidrógeno. Por ejemplo, puede haber compuestos con más de un átomo de hidrógeno por molécula, pero podrían liberar solo un átomo de hidrógeno.
Además, dado que solo se dona un átomo de hidrógeno, podemos predecir y calcular fácilmente el pH de un ácido monoprótico. En contraste, una base monoprótica puede aceptar solo un protón o átomo de hidrógeno. Algunos ejemplos de ácidos monopróticos incluyen ácido clorhídrico, ácido nítrico, ácido acético, etc.
¿Qué es un ácido diprótico??
Las moléculas de ácido diprótico son ácidos que pueden donar dos protones o átomos de hidrógeno por molécula. Este tipo de ácido puede donar dos protones a su solución acuosa. El término opuesto para diprótico es monoprótico (es decir, un protón o átomo de hidrógeno por molécula). Algunos ejemplos comunes de ácidos dipróticos incluyen ácido sulfúrico, ácido carbónico y ácido oxálico.

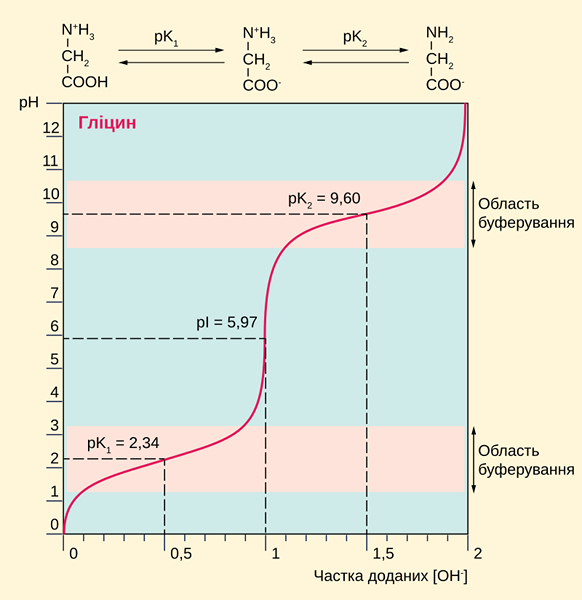
Figura 01: la glicina es un ácido diprótico (Esta curva muestra los valores de pH en los que los dos protones se donan a la solución acuosa)
Los ácidos dipróticos pueden producir dos iones H+ por molécula ácida. Por lo tanto, estos ácidos pueden aumentar la concentración de soluciones de iones de hidrógeno y, por lo tanto, disminuir el valor de pH debido a la alta acidez. Podemos identificar un ácido diprótico titulando con una solución de hidróxido de sodio que tiene una concentración conocida.
¿Cuál es la diferencia entre ácido monoprótico y diprótico??
La diferencia clave entre el ácido monoprótico y diprótico es que los ácidos monopóticos pueden donar un átomo de hidrógeno o protón a su solución acuosa, mientras que los ácidos dipróticos pueden donar dos átomos de hidrógeno o protones a su solución acuosa. El ácido clorhídrico, el ácido nítrico y el ácido acético son ejemplos de ácidos monopróticos, mientras que el ácido sulfúrico, el ácido carbónico y el ácido oxálico son ejemplos de ácidos dipróticos. En general, los ácidos monopóticos son más ácidos que los ácidos dipróticos.
La siguiente infografía presenta las diferencias entre el ácido monoprótico y diprótico en forma tabular para la comparación de lado a lado.
Resumen - ácido monoprótico vs diprótico
La diferencia clave entre el ácido monoprótico y diprótico es que los ácidos monopóticos pueden donar un átomo de hidrógeno o protón a su solución acuosa, mientras que los ácidos dipróticos pueden donar dos átomos de hidrógeno o protones a su solución acuosa.
Referencia:
1. Helmenstine, Anne Marie. "Definición de ácido monoprótico."Thinkco, agosto. 27, 2020.
Imagen de cortesía:
1. "Curva de titulación de glicina" de Zlir'a - Trabajo propio (CC0) a través de Commons Wikimedia


