¿Cuál es la diferencia entre la electroforesis de gel nativo y desnaturalizante?

El diferencia clave entre la electroforesis de gel nativo y desnaturalizante es que en la electroforesis en gel nativa, la biomolécula de interés se mantiene su estructura normal o nativa cuando la ejecuta a través del gel, mientras que en electroforesis en gel desnaturalizante, la biomolécula de interés no se mantiene su estructura normal o nativa cuando lo ejecuta a través del gel.
La electroforesis en gel es una técnica de laboratorio para separar el ADN, el ARN o las proteínas de acuerdo con su tamaño molecular. En la electroforesis en gel, la biomolécula de interés es empujada por un campo eléctrico a través de un gel que contiene pequeños poros. Aquí, la molécula más corta se mueve más rápido que la molécula más larga. Esto se debe a que la molécula más corta migra fácilmente a través de los pequeños poros en el gel. Esta propiedad se llama tamizado molecular. La electroforesis en gel nativa y desnaturalizante son dos tipos diferentes de técnicas de electroforesis en gel utilizadas para separar biomoléculas como ADN, ARN y proteínas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la electroforesis de gel nativo?
3. ¿Qué es la electroforesis en gel desnaturalizante?
4. Similitudes: electroforesis en gel nativa y desnaturalizante
5. Electroforesis de gel nativo vs desnaturalizante en forma tabular
6. Resumen: electroforesis en gel nativo vs desnaturalizante
¿Qué es la electroforesis de gel nativo??
En la electroforesis en gel nativa, la biomolécula (ADN, ARN o proteína) de interés mantiene su estructura normal o nativa cuando se ejecuta a través del gel. En la electroforesis en gel nativa, la biomolécula se separa en función de la forma y la longitud. Por lo tanto, en esta electroforesis, las biomoléculas se separan en función del tamaño, la forma y la carga neta de su estructura nativa al tiempo que preservan su función y actividad.

Figura 01: Electroforesis de gel nativo
Las biomoléculas como el ADN, el ARN y las proteínas normalmente tienen una carga negativa neta. Las biomoléculas con una mayor densidad de carga negativa migrarán más rápido. Además, las biomoléculas más pequeñas tendrán una fuerza de fricción más pequeña en comparación con las biomoléculas más grandes, por lo que ellos también migrarán más rápido. Como resultado de esto, las biomoléculas en la electroforesis en gel nativa se separan en función de su masa y carga.
¿Qué es la electroforesis en gel desnaturalizante??
En la electroforesis en gel desnaturalizante, la biomolécula de interés no mantiene su estructura normal o nativa cuando se ejecuta a través del gel. Separa biomoléculas sobre la base de la longitud. La electroforesis de gel desnaturalizante destruye la estructura compleja de las biomoléculas para que las moléculas se separen solo en función de su masa cuando se electroforesis.
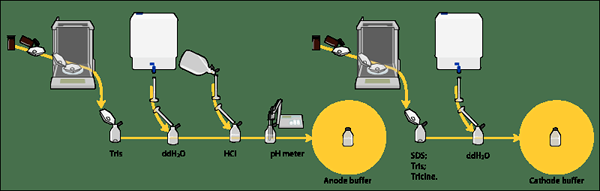
Figura 02: electroforesis de gel desnaturalizante
Un ejemplo común de electroforesis en gel desnaturalizante es la página SDS (electroforesis en gel de poliacrilamida SDS), utilizada para la separación de proteínas. En la página SDS, las muestras de proteínas se calientan a 100OC en presencia de detergente aniónico como SDS (dodecil sulfato de sodio). Este agente reductor rompe los enlaces disulfuro de las proteínas y destruye su estructura de proteínas cuaternarias. SDS también confiere una carga negativa general a las proteínas. Este proceso permite que las proteínas se separen basándose únicamente en su tamaño o masa. La página SDS es útil para determinar el peso molecular de las proteínas también.
¿Cuáles son las similitudes entre la electroforesis de gel nativo y desnaturalizante??
- La electroforesis en gel nativa y desnaturalizante son dos tipos diferentes de técnicas de electroforesis en gel utilizadas para separar biomoléculas como ADN, ARN y proteínas.
- Ambas son técnicas de laboratorio biológico molecular.
- Ambas técnicas deben ser realizadas por técnicos calificados.
- El tamaño de las biomoléculas se puede determinar utilizando ambas técnicas de electroforesis en gel.
- Las escaleras moleculares se utilizan para determinar los tamaños de las biomoléculas en ambas técnicas de electroforesis en gel.
¿Cuál es la diferencia entre la electroforesis de gel nativo y desnaturalizante??
En la electroforesis en gel nativa, la biomolécula de interés mantiene su estructura normal o nativa cuando se extiende a través del gel, mientras que en la electroforesis en gel desnaturalizante, la biomolécula de interés no mantiene su estructura normal o nativa cuando atraviesa el gel. Por lo tanto, esta es la diferencia clave entre la electroforesis de gel nativo y desnaturalizante. Además, los agentes reductores como SDS (dodecil sulfato de sodio) y DTT (ditiotreitol) no se utilizan en la electroforesis en gel nativa, mientras que los agentes reductores como SDS (dodecil sulfato de sodio) y DTT (Dithiothreitol) se usan para la desnaturalización en la electroesis del gel en el gel electroesis.
La siguiente infografía presenta las diferencias entre la electroforesis de gel nativo y desnaturalizante en forma tabular para la comparación de lado a lado.
Resumen: electroforesis en gel nativo vs desnaturalizante
La electroforesis en gel nativa y desnaturalizante son dos tipos diferentes de técnicas de electroforesis en gel utilizadas para separar biomoléculas como ácidos nucleicos y proteínas. Son técnicas de laboratorio biológico molecular comúnmente utilizadas en laboratorios modernos. Sin embargo, en la electroforesis en gel nativa, la biomolécula de interés mantiene su estructura normal o nativa cuando se ejecuta a través del gel. En contraste, en la electroforesis en gel desnaturalizante, la biomolécula de interés no mantiene su estructura normal o nativa cuando se ejecuta a través del gel. Entonces, esta es la diferencia clave entre la electroforesis de gel nativo y desnaturalizante.
Referencia:
1. "Electroforesis en gel desnaturalizante."Una descripción general | Temas de ciencias.
2. "Gel nativo o desnaturalizante, que es para ti?"Advansta Inc.
Imagen de cortesía:
1. "Electroforesis en gel" de McKenzielower - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. "Buffers SDS-Page" de Bensaccount en English Wikipedia (CC por 3.0) a través de Commons Wikimedia


