¿Cuál es la diferencia entre la inhibición no competitiva y alostérica?
El diferencia clave entre la inhibición no competitiva y alostérica es que en la inhibición no competitiva, la tasa máxima de reacción catalizada (VMAX) disminuye y la concentración de sustrato (KM) permanece sin cambios, mientras que en la inhibición alostérica, Vmax permanece sin cambios y KM aumenta.
Las enzimas son esenciales para la mayoría de las reacciones que tienen lugar en los organismos. Por lo general, una enzima cataliza una reacción al reducir la energía de activación requerida para la reacción. Pero las enzimas deben regularse cuidadosamente para controlar los niveles de productos finales que se elevan a niveles no deseados. Se controla por inhibición enzimática. Un inhibidor de la enzima es una molécula que perturba la vía de reacción normal entre una enzima y un sustrato.
Un sitio activo es la región de una enzima donde los sustratos se unen y sufren una reacción química. Un sitio alostérico es donde permite que las moléculas activen o inhiban la actividad enzimática. La cinética enzimática juega un papel importante durante la inhibición de la enzima. La tasa máxima de reacción característica de una enzima particular a una concentración particular se conoce como la velocidad máxima o vmax. La concentración del sustrato que da la tasa que es la mitad de Vmax es km.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la inhibición no competitiva?
3. ¿Qué es la inhibición alostérica?
4. Similitudes: inhibición no competitiva y alostérica
5. Inhibición no competitiva versus alostérica en forma tabular
6. Resumen - Inhibición no competitiva versus alostérica
¿Qué es la inhibición no competitiva??
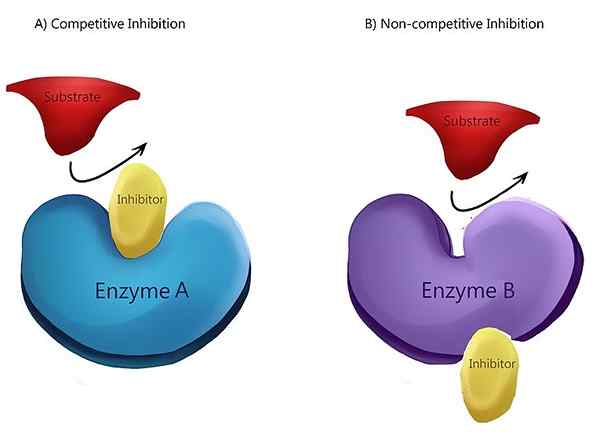
La inhibición no competitiva es un tipo de inhibición enzimática donde el inhibidor reduce la actividad enzimática y se une igualmente bien a la enzima, ya sea que esté unido al sustrato o no. En otras palabras, la inhibición no competitiva es donde el inhibidor y el sustrato se unen a la enzima en un momento dado. Cuando tanto el sustrato como el inhibidor se unen con la enzima, forma un complejo enzimático-substrato inhibidor. Una vez que se forma este complejo, no puede producir ningún producto. Solo puede convertirse de nuevo al complejo enzimático-sustrato o al complejo enzimático inhibidor.

Figura 01: inhibición no competitiva
En la inhibición no competitiva, el inhibidor tiene la misma afinidad por la enzima y el complejo enzimático-sustrato. El mecanismo más común de un inhibidor no competitivo es la unión reversible del inhibidor a un sitio alostérico. Pero el inhibidor también tiene la capacidad de unirse directamente al sitio activo. Un ejemplo de un inhibidor no competitivo es la conversión de la piruvato quinasa en piruvato. La conversión de fosfoenolpiruvato para producir piruvato es catalizada por la piruvato quinasa. Un aminoácido llamado alanina, que se sintetiza a partir de piruvato, inhibe la enzima piruvato quinasa durante la glucólisis. Alanine actúa como un inhibidor no competitivo.
¿Qué es la inhibición alostérica??
La inhibición alostérica es un tipo de inhibición enzimática donde el inhibidor ralentiza la actividad enzimática desactivando la enzima y la unión a la enzima en el sitio alostérico. Aquí, el inhibidor no compite directamente con el sustrato en el sitio activo. Pero, cambia indirectamente la composición de la enzima. Una vez que se cambia la forma, la enzima se vuelve inactiva. Por lo tanto, ya no puede unirse con el sustrato correspondiente. Esto, a su vez, ralentiza la formación de productos finales.
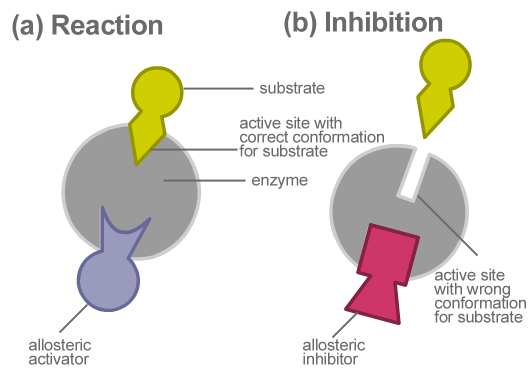
Figura 02: inhibición alostérica
La inhibición alostérica evita la formación de productos innecesarios, reduciendo el desperdicio de energía. Un ejemplo de inhibición alostérica es la conversión de ADP a ATP en la glucólisis. Aquí, cuando hay un exceso de ATP en el sistema, ATP sirve como un inhibidor alostérico. Se une a la fosfofructinasa, que es una de las enzimas involucradas en la glucólisis. Esto ralentiza la conversión de ADP. Como resultado, ATP evita la producción innecesaria de sí mismo. Por lo tanto, no se necesita exceso de producción de ATP cuando hay cantidades adecuadas.
¿Cuáles son las similitudes entre la inhibición no competitiva y alostérica??
- Ambos tipos de inhibiciones enzimáticas ralentizan la actividad enzimática.
- Los inhibidores en ambas inhibiciones enzimáticas no compiten con el sustrato en el sitio activo.
- Los inhibidores cambian la composición de la enzima indirectamente.
- Ambos inhibidores cambian la forma de la enzima.
¿Cuál es la diferencia entre la inhibición no competitiva y alostérica??
En la inhibición no competitiva, el Vmax de la reacción disminuye mientras deja el valor de km sin cambios. En contraste, en la inhibición alostérica, el Vmax permanece sin cambios y el valor de KM aumenta. Entonces, esta es la diferencia clave entre la inhibición no competitiva y alostérica. La inhibición alostérica se centra más en el uso de productos químicos que altera la actividad enzimática al unirse en un sitio alostérico, mientras que los inhibidores no competitivos siempre detienen la enzima de trabajo al unirse directamente en un sitio alternativo.
La siguiente infografía tabula las diferencias entre la inhibición no competitiva y alostérica para la comparación de lado a lado.
Resumen -Inhibición no competitiva versus alostérica
La inhibición no competitiva es una inhibición enzimática en la que el inhibidor reduce la actividad enzimática y se une igualmente bien a la enzima si está unido al sustrato o no. La inhibición alostérica es un tipo de inhibición enzimática donde el inhibidor ralentiza la actividad enzimática desactivando la enzima y se une a la enzima en el sitio alostérico. La diferencia clave entre la inhibición no competitiva y alostérica es que la tasa máxima de reacción catalizada (VMAX) se reduce, y la concentración del sustrato (km) permanece sin cambios en la inhibición no competitiva, mientras que el VMAX permanece sin cambios, y KM se incrementa en Allostérico inhibición.
Referencia:
1. "Regulación alostérica: protocolo."Jove.
2. "Enzimas."Microbiología ilimitada.
Imagen de cortesía:
1. "Inhibición enzimática competitiva y no competitiva" por California16 - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
2. "Inhibición alostérica" por [[: en: user: 1 | 1]] en la wikipedia en inglés (cc by-sa 3.0) a través de Commons Wikimedia


