¿Cuál es la diferencia entre PFK-1 y PFK-2?
El diferencia clave Entre PFK-1 y PFK-2 es que PFK-1 cataliza la conversión de fructosa 6-fosfato y ATP a fructosa 1,6-bisfosfato y ADP, mientras que PFK-2 cataliza la síntesis de fructosa 2,6-bisfosfato de fructosa 6- 6- fosfato.
La fosfofructoquinasa-1 (PFK-1) y la fosfofructoquinasa-2 (PFK-2) son dos enzimas. PFK-1 es una enzima glucolítica que cataliza la reacción de la fructosa 6-fosfato, convirtiéndola en fructosa 1,6-bishosfato. Es el paso limitante de la tasa de la glucólisis. Cuando el nivel de glucosa es alto, y es necesario regular la glucólisis, PFK-2 cataliza la síntesis de fructosa 2,6-bisfosfato de fructosa 6-fosfato. La fructosa 2,6-bisfosfato es un poderoso activador alostérico de PFK-1 para mejorar la descomposición de la glucosa. PFK-2 no es una enzima glucolítica. Pero, tanto PFK-1 como PFK-2 actúan en el mismo sustrato.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es PFK-1?
3. ¿Qué es PFK-2?
4. Similitudes-PFK-1 y PFK-2
5. PFK-1 vs PFK-2 en forma tabular
6. Resumen-PFK-1 vs PFK-2
¿Qué es PFK-1??
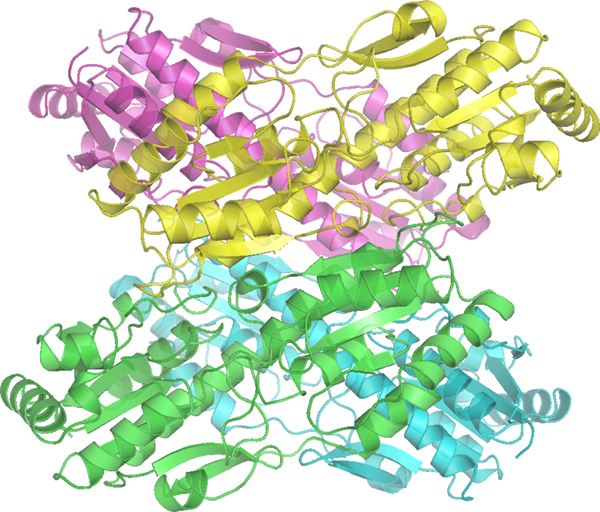
PFK-1 es la primera enzima cometida en glucólisis. De hecho, es la enzima limitante de la tasa de la glucólisis. Cataliza la conversión de fructosa 6-fosfato en fructosa 1,6-bisfoshato. PFK-1 usa ATP para esta reacción. Por lo tanto, PFK-1 se ve afectado por la concentración de ATP. La inhibición de PFK-1 por ATP es parte del circuito de retroalimentación negativa que regula el flujo de glucólisis bajo un estado aeróbico. Además de ATP, la actividad de PFK-1 está regulada por varias otras moléculas, incluida la fructosa 2,6-bisfosfato, AMP y citrato.

Figura 01: PFK-1
La fructosa 2,6-bisfosfato es un poderoso activador alostérico de PFK-1. En condiciones fisiológicas, PFK-1 permanece inactivo. Cuando interactúa con la fructosa 2,6-bisfoshate, se activa y estimula la vía glucolítica para aumentar la descomposición de la glucosa. El flujo en la dirección de la glucólisis aumenta considerablemente por la fructosa 2,6-bisfosfato debido a su capacidad de activación alostérica de PFK-1. De manera similar, AMP también actúa como un efector alostérico para activar PFK-1. En contraste, el citrato actúa como un inhibidor alostérico de PFK1. El magnesio actúa como el co-factor de PFK-1.
¿Qué es PFK-2??
La fructosa 2,6-bisfosfato es un metabolito que regula la glucólisis y la gluconeogénesis. PFK-2 o fosfofructoquinasa-2 es la enzima que cataliza la síntesis de fructosa 2,6-bisfosfato de fructosa 6-fosfato. Similar a PFK-1, PFK-2 actúa en el mismo sustrato. Sin embargo, a diferencia de PFK-1, la actividad de PFK-2 no se ve afectada por la concentración de ATP. El fosfoenolpiruvato y el citrato pueden inhibir esta enzima, mientras que el ortofosfato inorgánico puede estimular la acción de PFK-2.
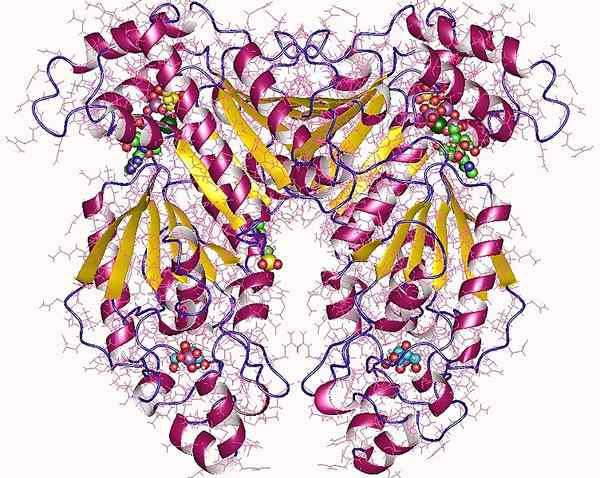
Figura 02: PFK-2
Estructuralmente, PFK-2 existe con fructosa-2,6-bisfosfatasa como una enzima bifuncional abreviada como PFK-2/FBPasa-2. PFK-2 fosforila fructosa 6-fosfato usando ATP. Por otro lado, la FBPasa-2 desfosforila fructosa 2,6-bisfosfato para producir fructosa 6-fosfato y Pi. Por lo tanto, PFK-2 tiene actividades de quinasa y fosfatasa. Cuando el nivel de glucosa es alto, la insulina aumenta la actividad de la quinasa de la enzima PFK-2 para impulsar el aumento de la síntesis de fructosa 2,6-bisfosfato. Estimula la glucólisis debido a la activación de PFK-1 por la fructosa 2,6-bisfosfato. En contraste, cuando se expresa la actividad de fosfatasa de PFK-2, rompe la fructosa 2,6-bisfosfato nuevamente en fructosa 6-fosfato, estimulando la gluconeogénesis e inhibe la glucólisis.
¿Cuáles son las similitudes entre PFK1 y PFK-2??
- PFK-1 y PFK-2 son dos enzimas.
- El sustrato de enzimas PFK-1 y PFK-2 es el mismo: fructosa 6-fosfato.
- Ambas enzimas son importantes en la regulación de la glucólisis.
- Las reacciones catalizadas por ambas enzimas producen ADP de ATP.
- El citrato puede inhibir ambas enzimas.
¿Cuál es la diferencia entre PFK-1 y PFK-2??
PFK-1 cataliza la conversión de fructosa 6-fosfato en fructosa 1,6-bisfosfato. En contraste, PFK-2 cataliza la conversión de fructosa 6-fosfato en fructosa 2,6-bisfosfato. Entonces, esta es la diferencia clave entre PFK1 y PFK-2. A diferencia de PFK-1, PFK-2 tiene actividad de quinasa y fosfatasa; Por lo tanto, es una enzima bi-funcional. Además, la fructosa 2,6-bisfosfato es un poderoso activador alostérico de PFK-1, mientras que PFK-2 cataliza la síntesis de fructosa 2,6-bisfosfato. Por lo tanto, esta es otra diferencia entre PFK-1 y PFK-2. Lo más importante es que la actividad de PFK-1 se ve afectada por ATP, mientras que la actividad de PFK-2 no se ve afectada por la concentración de ATP.
La siguiente infografía enumera las diferencias entre PFK-1 y PFK-2 en forma tabular para la comparación de lado a lado.
Resumen-PFK-1 vs PFK-2
PFK-1 cataliza la conversión de fructosa 6-fosfato y ATP a fructosa 1,6-bisfosfato y ADP. PFK-2 cataliza la síntesis de fructosa 2,6-fosfato de fructosa 6-fosfato. La actividad de PFK-1 se ve afectada por la concentración de ATP. En contraste, PFK-2 no se ve afectado por la concentración de ATP. Lo más importante, PFK-2 tiene actividades de quinasa y fosfatasa; Por lo tanto, es una enzima bi-funcional. PFK-1 no es una enzima bi-funcional. Además, PFK-1 es una enzima limitante de la velocidad de la glucólisis, mientras que PFK-2 no se considera una enzima glucolítica. Por lo tanto, este es el resumen de la diferencia entre PFK-1 y PFK-2.
Referencia:
1. Ros, Susana y Almut Schulze. "Equilibrando el flujo glucolítico: el papel de 6-fosfofructo-2-quinasa/fructosa 2,6-bisfosfatasas en el metabolismo del cáncer."Cancer & Metabolism, Biomed Central, 4 de febrero. 2013.
2. "Fosfofructoquinasa 2."Wikipedia, Fundación Wikimedia, 5 de julio de 2021.
Imagen de cortesía:
1. "Fosfofructocinasa 6PFK WPMP" de Zephyris en English Wikipedia - Transferido desde EN.Wikipedia a Commons por Patríciar. (CC BY-SA 3.0) a través de Commons Wikimedia
2. "5htk" por autores de deposición: crochet, r.B.; Autor de visualización: Usuario: Astrojan -(CC BY -SA 4.0) a través de Commons Wikimedia


