¿Cuál es la diferencia entre alosterismo positivo y negativo?
El Diferencia clave entre alosterismo positivo y negativo es que el alosterismo positivo en las proteínas muestra una alta afinidad por los ligandos, mientras que el alosterismo negativo en las proteínas muestra una baja afinidad por los ligandos.
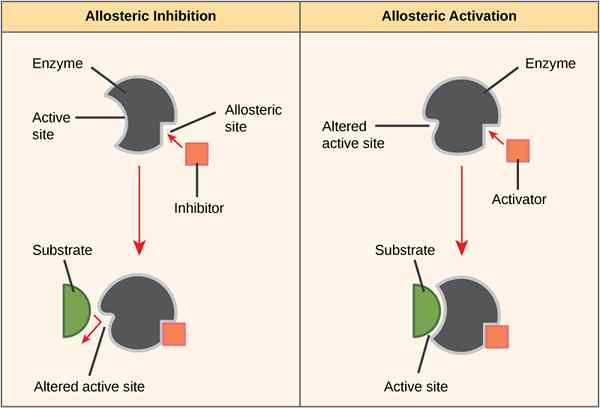
El alosterismo o el comportamiento alostérico es el fenómeno en el que la actividad de una proteína puede alterarse dependiendo de la unión de algunas moléculas en un sitio que no sea el sitio activo de la proteína (específicamente en enzimas). Un alosterismo positivo indica que la unión de una molécula efectora a una enzima hace que la enzima cambie su configuración en una forma activa. Por el contrario, un Allosteirsm negativo indica que una unión de la molécula efector hace que la enzima cambie su configuración de una forma activa a una forma inactiva.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el alosterismo positivo?
3. ¿Qué es el alosterismo negativo?
4. Alloterismo positivo versus negativo en forma tabular
5. Resumen -Alloterismo positivo vs negativo
¿Qué es el alosterismo positivo??
El alosterismo positivo es el cambio en la configuración de una proteína (principalmente una enzima) de una forma inactiva a una forma activa sobre la unión de una molécula efector. La molécula efector se une con un sitio que no sea el sitio activo de la enzima; se llama el sitio alostérico. Este proceso también se conoce como activación alostérica.
Un ejemplo común para dicha unión a la molécula efector es la unión de la molécula de oxígeno con la molécula de hemoglobina, que activa la molécula de hemoglobina para transportar efectivamente el oxígeno a las células. Allí, la molécula de oxígeno se une con el hierro ferroso de una molécula hemo en la molécula de hemoglobina. La forma activa se conoce como oxi-hemoglobina, mientras que la forma inactiva se conoce como desoxi-hemoglobina.
¿Qué es el alosterismo negativo??
El alosterismo negativo es el cambio en la configuración de una enzima de una forma activa a una forma inactiva sobre la unión de una molécula efector. La molécula efector se une con un sitio que no sea el sitio activo de la enzima; se llama el sitio alostérico. Este proceso también se conoce como inhibición alostérica.

Figura 01: Alloterismo positivo y negativo
Durante el alosterismo negativo, la unión de un ligando disminuye la afinidad de la enzima por sustrato en los otros sitios activos disponibles para la unión del sustrato. Un ejemplo es la unión de 2,3-bpg a un sitio alostérico en la hemoglobina, lo que provoca una disminución en la afinidad por el oxígeno de todas las subunidades.
¿Cuál es la diferencia entre alosterismo positivo y negativo??
En un alosterismo positivo, la unión de una molécula efectora a una enzima hace que la enzima cambie su configuración en una forma activa, mientras que en Allosteirsm negativo, la unión de una molécula efectora hace que la enzima cambie de configuración de forma activa a la forma inactiva a la forma inactiva. La diferencia clave entre el alosterismo positivo y negativo es que el alosterismo positivo en las proteínas muestra una alta afinidad por los ligandos, mientras que el alosterismo negativo en las proteínas muestra una baja afinidad por los ligandos. Además, el alosterismo positivo implica la activación, mientras que el Allosteirsm negativo implica la inhibición. La unión del oxígeno con la hemoglobina es un ejemplo de alosterismo positivo, mientras que la unión de 2,3-bpg con hemoglobina es un ejemplo de alosterismo negativo.
La siguiente infografía presenta la diferencia entre el alosterismo positivo y negativo en forma tabular para la comparación de lado a lado.
Resumen -Alloterismo positivo vs negativo
En el alosterismo o el comportamiento alostérico, la actividad de una proteína puede alterarse dependiendo de la unión de algunas moléculas en un sitio que no sea el sitio activo de la proteína (específicamente en enzimas). La diferencia clave entre el alosterismo positivo y negativo es que el alosterismo positivo en las proteínas muestra una alta afinidad por los ligandos, mientras que el alosterismo negativo en las proteínas muestra una baja afinidad por los ligandos.
Referencia:
1. "3.6: Interacciones alostéricas." Bibliotecas de química, Libretexts, 17 de julio de 2020.
Imagen de cortesía:
2. "Figura 06 05 05 - Activación e inhibición alostérica" de CNX OpenStax - (CC por 4.0) a través de Commons Wikimedia


