¿Cuál es la diferencia entre el ácido protícico y el ácido de Lewis?
El Diferencia clave entre el ácido protícico y el ácido de Lewis es que los ácidos protícicos son donantes de protones, mientras que los ácidos de Lewis son aceptores de protones.
Los ácidos protícicos son compuestos químicos que pueden producir un protón o un ion hidronio en su solución al liberar un protón. Un ácido de Lewis es un compuesto químico que puede aceptar un par de electrones de una especie química donadora de electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el ácido protícico?
3. ¿Qué es el ácido de Lewis?
4. Ácido protico vs ácido Lewis en forma tabular
5. Resumen - ácido protícico contra ácido Lewis
¿Qué es el ácido protícico??
Los ácidos protícicos son compuestos químicos que pueden producir un protón o un ion hidronio liberando un protón. Esta liberación de protones ocurre porque estos ácidos pueden aceptar un par de electrones del oh-ion en el agua actuando como un ácido de Lewis, pero no puede producir un ion hidronio o un protón por sí mismo.
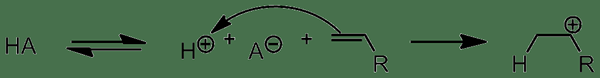
Figura 01: Acción de ácidos protícicos
Hay tres tipos principales de ácidos protícicos como ácidos monopróticos, ácidos polipóticos y ácidos dipróticos . Los ácidos monopróticos pueden liberar un protón a la solución, mientras que los ácidos dipróticos pueden liberar dos protones. Por otro lado, los ácidos polipóticos pueden liberar más de dos protones. En los ácidos polipróticos, los protones se liberan en varios pasos. Sin embargo, el primer protón se pierde del ácido más fácilmente que el próximo protón.
¿Qué es el ácido de Lewis??
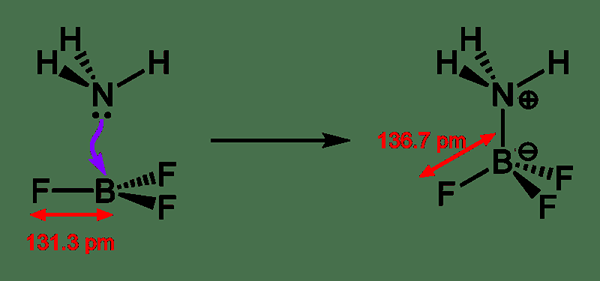
Un ácido de Lewis es un compuesto químico que puede aceptar un par de electrones de una especie química donadora de electrones. Este tipo de compuesto ácido contiene un orbital vacío que puede aceptar un par de electrones de una base de Lewis, formando un aducto de Lewis. En contraste, la base de Lewis es una especie química que tiene un orbital relleno que consiste en un par de electrones. Este par de electrones no participa en la unión, pero puede formar enlaces dativos con ácidos de Lewis para formar un aducto de Lewis.

Figura 02: Formación de un aducto de Lewis
Por lo general, el término ácido Lewis solo se usa con compuestos químicos planos trigonales que contienen un orbital P vacío. Allí, podemos tratar incluso compuestos complejos como ET3Al2Cl3 como compuestos planos trigonales que pueden llamarse Lewis Acids. Además de la formación de aductos de Lewis, otras reacciones que involucran ácidos de Lewis se conocen como reacciones catalizadas por ácido. A veces, nos encontramos con compuestos químicos como H2O que tienen propiedades base de Lewis ácido y Lewis. Esto se debe a que estos compuestos pueden donar o aceptar pares de electrones, dependiendo de la reacción química en la que están involucrados.
Hay varios ácidos de Lewis. Los ácidos de Lewis más simples tienden a reaccionar fácil y directamente con las bases de Lewis. Los ácidos de Lewis más comunes tienden a sufrir una reacción química antes de la formación del aducto. Algunos ejemplos para los ácidos de Lewis incluyen iones onium como iones de amonio e iones de hidronio, cationes metálicos como iones férricos, especies planas trigonales como BF3, sistemas PI pobres en electrones como enones, etc. Los tres tipos principales de ácidos de Lewis incluyen ácidos simples de Lewis, ácidos de lewis complejos y ácido H+ Lewis. La aplicación más común de los ácidos de Lewis es la alquilación de Friedel-Crafts.
¿Cuál es la diferencia entre el ácido protícico y el ácido de Lewis??
Podemos distinguir los ácidos protícicos de los ácidos de Lewis a través de la acción de la liberación de protones del compuesto ácido. La diferencia clave entre el ácido protícico y el ácido de Lewis es que los ácidos protícicos son donantes de protones, mientras que los ácidos de Lewis son aceptores de protones.
La siguiente infografía presenta la diferencia entre el ácido protícico y el ácido de Lewis en forma tabular.
Resumen -ácido protícico contra ácido Lewis
En conclusión, los ácidos protícicos difieren de los ácidos de Lewis dependiendo de la capacidad de estos compuestos para liberar protones a la solución. La diferencia clave entre el ácido protícico y el ácido de Lewis es que los ácidos protícicos son donantes de protones, mientras que los ácidos de Lewis son aceptores de protones.
Referencia:
1. "Ácidos y bases polipróticas." Bibliotecas de química, Libretexts, 15 de agosto. 2020.
Imagen de cortesía:
1. "Iniciación de ácido protícico" por Matchem121 - Trabajo propio (CC por 3.0) a través de Commons Wikimedia
2. "NH3-BF3-Aducto-Bond-Lenging-2D" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia


