¿Cuál es la diferencia entre vapor saturado y vapor sobrecalentado?
La clave diferencia entre vapor saturado y vapor sobrecalentado es que el vapor saturado es el límite máximo de vapor que puede contener un espacio dado, y este vapor puede condensarse, mientras que el vapor sobrecalentado es el tipo de vapor que se separa de las gotas de líquido seguido de la adición de calor adicional, y él no es capaz de condensar.
El vapor es una sustancia difundida o suspendida en el aire, especialmente una normalmente líquida o sólida. Vapor saturado y vapor sobrecalentado son dos tipos diferentes de vapor. Vapor saturado y vapor sobrecalentado son términos muy importantes en química debido a sus diferentes aplicaciones en diferentes tecnologías.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es vapor saturado?
3. ¿Qué es el vapor sobrecalentado?
4. Vapor saturado vs vapor sobrecalentado en forma tabular
5. Resumen: vapor saturado frente a vapor sobrecalentado
¿Qué es vapor saturado??
El vapor saturado es el límite máximo de vapor que una cantidad dada de aire puede mantener a una temperatura particular. Por ejemplo, el vapor de agua saturado significa la cantidad máxima de vapor de agua que una cantidad dada de aire puede mantener a una temperatura dada. Por lo tanto, la humedad relativa será del 100%. Cuando no se alcanza el límite máximo de vapor, este estado se llama vapor insaturado. Es lo opuesto al vapor saturado.
Además, el vapor saturado seco está libre de partículas líquidas. En otras palabras, el vapor seco se forma cuando todas las partículas del líquido se vaporizan. Por lo tanto, cualquier aumento en la presión del vapor o la disminución de la temperatura del vapor puede causar la condensación de partículas líquidas en el vapor.
Cuando un líquido continúa evaporándose en el espacio sobre él, la presión del vapor aumenta. Llega un punto en el que la tasa de evaporación se vuelve igual a la tasa de condensación, y el espacio se sature en este punto. Lo llamamos el estado de vapor saturado.
¿Qué es el vapor sobrecalentado??
El vapor sobrecalentado es el vapor formado a partir de un disolvente que se calienta más allá de su punto de ebullición normal a presión atmosférica. Este tipo de vapor puede calentar materiales a temperaturas por encima del punto de ebullición normal del solvente que estamos utilizando para producir el vapor.
El término sobrecalentado significa que el vapor ocurre a una temperatura de vaporización que está por encima de su punto de ebullición a una presión dada. Por ejemplo, si el vapor de agua está ocurriendo a una temperatura entre 100 y 1000 grados centígrados a la presión atmosférica, entonces podemos llamarlo vapor de agua sobrecalentado, y se puede suponer bastante que puede comportarse como un gas ideal.

Dado que el vapor sobrecalentado puede liberar una gran cantidad de energía interna para el trabajo y puede permanecer por encima del punto de vapor de agua del líquido a una presión dada, es útil para diferentes aplicaciones. Algunas de estas aplicaciones incluyen tecnologías de superficie, tecnologías de limpieza, secado por vapor, catálisis, procesamiento de reacción química, tecnologías de curado, sistemas de energía y nanotecnología.
¿Cuál es la diferencia entre vapor saturado y vapor sobrecalentado??
La diferencia clave entre el vapor saturado y el vapor sobrecalentado es que el vapor saturado es el límite máximo de vapor que puede contener un espacio dado, y este vapor puede condensarse, mientras que el vapor sobrecalentado es el tipo de vapor que se separa de las gotas de líquido seguidas mediante la adición de calor adicional, y no puede condensar.
A continuación se muestra un resumen de la diferencia entre el vapor saturado y el vapor sobrecalentado en forma tabular para la comparación de lado a lado.
Resumen: vapor saturado frente a vapor sobrecalentado
Vapor saturado y vapor sobrecalentado son dos tipos diferentes de vapor. La diferencia clave entre el vapor saturado y el vapor sobrecalentado es que el vapor saturado es el límite máximo de vapor que puede contener un espacio dado, y este vapor puede condensarse, mientras que el vapor sobrecalentado es el tipo de vapor que se separa de las gotas de líquido seguidas mediante la adición de calor adicional y no puede condensar.
Referencia:
"Vapor sobrecalentado." Una descripción general | Temas de ciencias.
Imagen de cortesía:
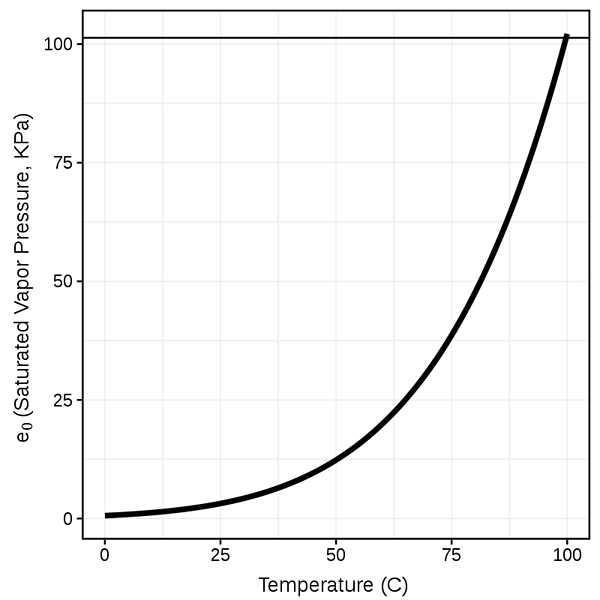
1. "Presión de vapor de saturación del agua" por FirePulaski - Trabajo propio (CC BY -SA 4.0) a través de Commons Wikimedia
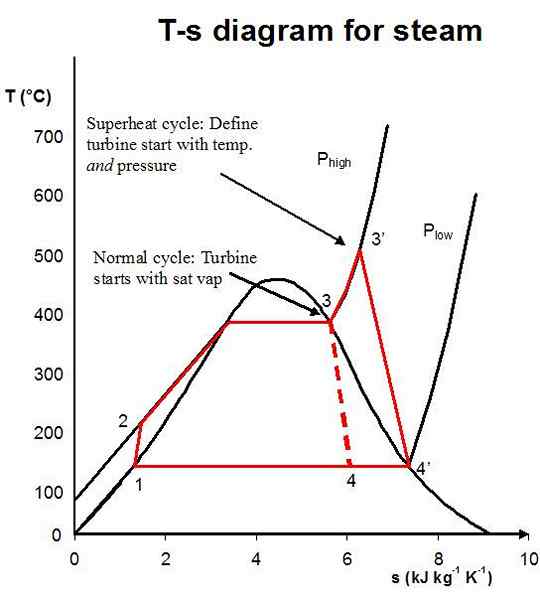
2. "Rankine ciclo con sobrecalentamiento" por DoneByTheSecondlaw en el Wikipedia en inglés (CC By-SA 3.0) a través de Commons Wikimedia


