¿Cuál es la diferencia entre los orbitales moleculares Sigma y Pi?
El Diferencia clave entre los orbitales moleculares Sigma y Pi es que el orbital molecular sigma se forma desde la superposición de los orbitales atómicos en una dirección directa a lo largo del eje internuclear, mientras que se forman orbitales moleculares de pi desde la superposición de orbitales atómicos en una dirección paralela.
Los orbitales moleculares Sigma y Pi son dos tipos de orbitales moleculares que contribuyen a la estructura real de un compuesto químico. Los orbitales moleculares son responsables de la formación de enlaces individuales y dobles o triples, respectivamente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los orbitales moleculares?
3. ¿Qué son los orbitales moleculares Sigma?
4. ¿Qué son los orbitales moleculares de Pi?
5. Orbitales moleculares Sigma vs Pi en forma tabular
6. Resumen - Orbitales moleculares Sigma vs Pi
¿Qué son los orbitales moleculares??
Los átomos se unen para formar moléculas. Cuando dos átomos se acercan para formar una molécula, los orbitales atómicos se superponen y se combinan para convertirse en orbitales moleculares. El número de orbitales moleculares recién formados es igual al número de orbitales atómicos combinados. Además, el orbital molecular rodea los dos núcleos de los átomos, y los electrones pueden moverse alrededor de ambos núcleos. Similar a los orbitales atómicos, los orbitales moleculares contienen al máximo 2 electrones, que tienen giros opuestos.
Además, hay dos tipos de orbitales moleculares como orbitales moleculares de unión y orbitales moleculares de antibondación. Los orbitales moleculares de unión contienen electrones en el estado fundamental, mientras que los orbitales moleculares de antibonding no contienen electrones en el estado fundamental. Además, los electrones pueden ocupar orbitales de antibonding si la molécula está en estado excitado.
¿Qué son los orbitales moleculares Sigma??
Los orbitales moleculares sigma son tipos de orbitales híbridos que se forman a partir de la superposición de dos orbitales atómicos de la cabeza a cabeza a lo largo del eje internuclear. Típicamente, el primer enlace covalente entre dos átomos es siempre un enlace sigma. La superposición de dos orbitales atómicos en el eje internuclear forma un enlace covalente Sigma. En un orbital molecular sigma, la densidad de electrones en el medio del orbital molecular es alta si los dos átomos de los cuales los orbitales atómicos se superponen son idénticos.

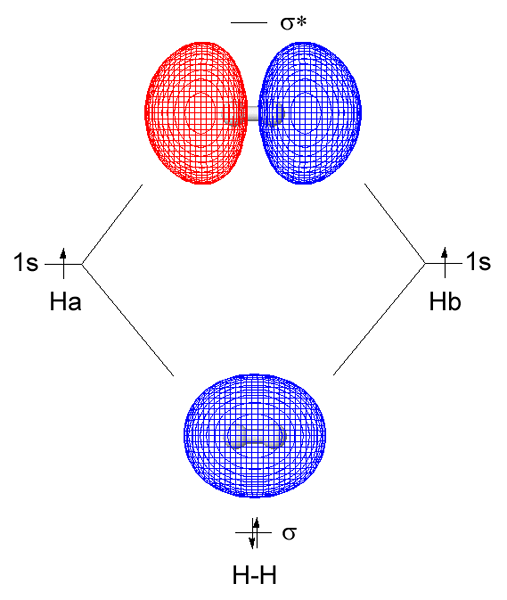
Figura 01: molécula de hidrógeno
Al considerar el hidrógeno como ejemplo, el orbital molecular Sigma se forma desde la superposición de dos orbitales atómicos de 1s provenientes de cada átomo de hidrógeno. Podemos abreviar este enlace sigma como σ. Aquí, la densidad de electrones compartido ocurre directamente entre los átomos de unión a lo largo del eje de enlace. Esto hace una interacción más estable entre dos átomos unidos junto con los electrones de unión en comparación con la estabilidad de los átomos separados. Típicamente, un enlace Sigma es el primer enlace que se forma entre dos átomos.
¿Qué son los orbitales moleculares de Pi??
Los orbitales moleculares Pi son tipos de orbitales híbridos que se forman desde la superposición de dos orbitales atómicos en la dirección paralela. Aquí, la densidad de electrones de unión ocurre por encima y por debajo del eje internuclear. Además, no podemos observar electrones en el eje de enlace. Este tipo de interacción entre dos átomos forma una disposición más estable que la estabilidad de los átomos libres separados. Por lo general, los electrones tienden a ocupar este tipo de orbitales moleculares cuando hay suficientes electrones en los átomos. Los orbitales moleculares Pi siempre se forman como segunda o tercera formación de orbital molecular con respecto a la unión de dos átomos porque el orbital molecular sigma es el primer enlace molecular que se formará entre dos átomos.
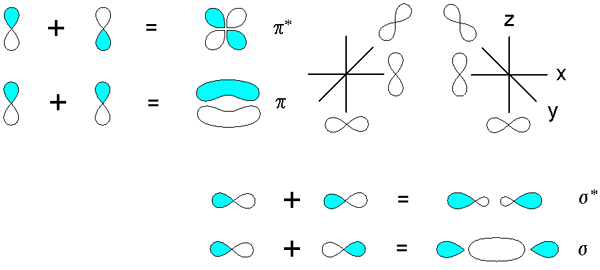
Figura 02: Orbitales moleculares de Pi
Además, el número de átomos que contribuyen a un orbital atómico P del sistema PI siempre es igual al número de orbitales moleculares PI presentes en un enlace químico. Típicamente, el orbital molecular PI más bajo tiene nodos verticales cero existentes. Aquí, los sucesivos orbitales moleculares PI obtienen un nodo vertical adicional al aumentar la energía. Podemos abreviar un orbital molecular Pi como π.
¿Cuál es la diferencia entre los orbitales moleculares Sigma y Pi??
Los orbitales moleculares Sigma y Pi son dos tipos de orbitales moleculares que contribuyen a la estructura real de un compuesto químico. La diferencia clave entre los orbitales moleculares Sigma y Pi es que se forma orbital molecular sigma desde la superposición de los orbitales atómicos en una dirección de cabeza a cabeza a lo largo del eje internuclear, mientras que los orbitales moleculares de Pi se forman desde la superposición de los orbitales atómicos en una dirección paralela.
La siguiente infografía enumera las diferencias entre los orbitales moleculares Sigma y PI en forma tabular para la comparación de lado a lado.
Resumen -Orbitales moleculares Sigma vs Pi
Un orbital molecular es un tipo de orbital que se forma desde la superposición de orbitales atómicos. La diferencia clave entre los orbitales moleculares Sigma y Pi es que se forma orbital molecular sigma desde la superposición de los orbitales atómicos en una dirección de cabeza a cabeza a lo largo del eje internuclear, mientras que los orbitales moleculares de Pi se forman desde la superposición de los orbitales atómicos en una dirección paralela.
Referencia:
1. "¿Qué es un orbital molecular sigma??" Byjus, 24 de diciembre. 2020.
1. "15.3: Pi Orbitales moleculares del benceno." Bibliotecas de química, Libretexts, 14 de julio de 2020.
Imagen de cortesía:
1. "Molécula de hidrógeno" por Chiraljon (CC por 2.0) a través de Flickr
2. "MO Diagrama PI Orbitals" de V8RIK en EN.Wikipedia (CC BY-SA 3.0) a través de Commons Wikimedia


