¿Cuál es la diferencia entre timolftaleína y fenolftaleína?

El Diferencia clave entre timolftaleína y fenolftaleína es que el cambio de color de la timolftaleína ocurre de color incoloro a azul, mientras que el cambio de color de la fenolftaleína ocurre de color incoloro a rosa al cambiar las condiciones de reacción de ácido a lo básico.
La timolftaleína y la fenolftaleína son dos indicadores de pH diferentes que son muy útiles en procesos analíticos titrimétricos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el timolftaleína?
3. ¿Qué es fenolphthalein?
4. Timolftaleína vs fenolftaleína en forma tabular
5. Resumen -Timolftaleína vs fenolftaleína
¿Qué es el timolftaleína??
La timolftaleína es un tipo de tinte de ftaleína que es útil como indicador de base ácida. La fórmula química de timolftaleína es C28H30O4. Es un indicador de pH que da su cambio de color en los cambios en el pH de la mezcla de reacción. El rango de pH de transición de este indicador es de alrededor de las 9.3 - 10.5. Timolftaleína es incoloro por debajo del pH 9.3, mientras que aparece en color azul a valores de pH superiores a 10.5. Además, el coeficiente de extinción molar de timolftaleína es de 38 000 m-1cm-1 a 595 nm para el anión indicador de color azul.
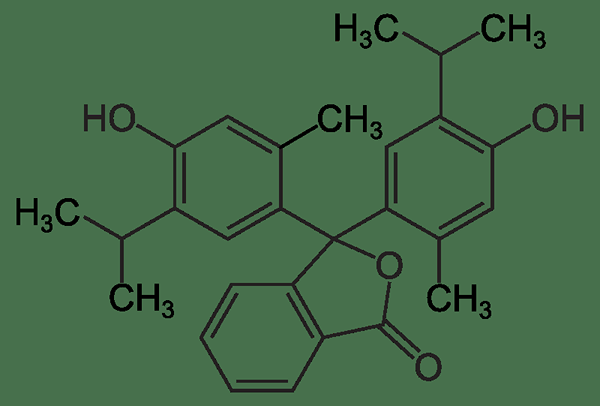
Figura 01: La estructura química del indicador de timolftaleína
La síntesis de timolftaleína se puede realizar usando timol y anhídrido ftálico. El producto de esta reacción de síntesis es un polvo blanco que también es la forma comercialmente disponible de timolftaleína. A altas temperaturas, esta sustancia tiende a descomponerse. Además, esta sustancia se usa como una tinta laxante y para desaparecer también.
¿Qué es fenolphthalein??
La fenolftaleína es un indicador de pH que es útil como indicador de titulación de base ácida. Este es un indicador muy común que a menudo usamos en nuestros procesos de valoración de laboratorio. La fórmula química de esta sustancia es C20H14O4. Podemos escribir este término simplemente como "hin" o como "phph". El color ácido de la fenolftaleína es incoloro, mientras que el color básico de la fenolftaleína es rosa. El rango de pH para este cambio de color es alrededor de las 8.3 - 10.0 ph.
Además, el indicador de fenolftaleína es ligeramente soluble en agua y, a menudo, se disuelve en los alcoholes. De esta manera, podemos usarlos fácilmente en titulaciones. La fenolftaleína es un ácido débil que puede liberar protones a la solución. La forma ácida de fenolftaleína no es iónica y es incolora. La forma desprotonada de fenolftaleína es de color rosa, y es una forma iónica. Si agregamos una base a la mezcla de reacción que consiste en un indicador de fenolftaleína, el equilibrio entre las formas iónicas y no iónicas tiende a cambiar hacia el estado desprotonado porque los protones se eliminan de la solución.

Figura 02: Color básico de la fenolftaleína
Con respecto a la síntesis del indicador de fenolftaleína, podemos producirla a partir de la condensación de anhídrido ftálico en presencia de dos equivalentes de fenol en condiciones ácidas. Además, esta reacción se puede catalizar usando una mezcla de cloruro de zinc y cloruro de tionilo.
¿Cuál es la diferencia entre timolftaleína y fenolftaleína??
La timolftaleína y la fenolftaleína son dos indicadores de pH diferentes que son muy útiles en procesos analíticos titrimétricos. La diferencia clave entre la timolftaleína y la fenolftaleína es que el cambio de color de timolftaleína ocurre de color incoloro a azul, mientras que el cambio de color de la fenolftaleína ocurre de color incoloro a rosa al cambiar las condiciones de reacción de ácido a básico. Además, el rango de pH activo de timolftalesína es 9.3 a 10.5 Mientras que el rango de pH activo de fenolftaleína es 8.3 a 10.0.
La siguiente infografía presenta las diferencias entre timolftaleína y fenolftaleína en forma tabular para la comparación de lado a lado.
Resumen -Timolftaleína vs fenolftaleína
La timolftaleína y la fenolftaleína son dos indicadores de pH diferentes que son muy útiles en procesos analíticos titrimétricos. La diferencia clave entre la timolftaleína y la fenolftaleína es que el cambio de color de timolftaleína ocurre de color incoloro a azul, mientras que el cambio de color de la fenolftaleína ocurre de color incoloro a rosa al cambiar las condiciones de reacción de ácido a básico.
Referencia:
1. "Fenolftaleína." Centro Nacional de Información de Biotecnología. Base de datos compuesto de pubchem, U.S. Biblioteca Nacional de Medicina.
Imagen de cortesía:
1. "Phenolphthalein-At-Ph-9" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Timolftaleína" de Neurotiker - Trabajo propio (dominio público) a través de Commons Wikimedia


