¿Cuál es la diferencia entre la celda voltaica y la célula electrolítica?
La diferencia clave entre la celda voltaica y la célula electrolítica es que una célula voltaica usa la energía que se libera durante una reacción redox espontánea para generar electricidad, mientras que una célula electrolítica usa la energía eléctrica de una fuente externa para forzar una reacción a.
Las células voltaica o las células galvánicas y las células electrolíticas son dos términos importantes en electroquímica. La electroquímica puede describirse como el estudio de la relación entre la electricidad y las reacciones químicas. Hay dos tipos de células electroquímicas; Son células voltaicas y células electrolíticas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es una celda voltaica?
3. ¿Qué es una célula electrolítica?
4. Celda voltaica frente a célula electrolítica en forma tabular
5. Resumen -celda voltaica frente a celda electrolítica
¿Qué es una celda voltaica??
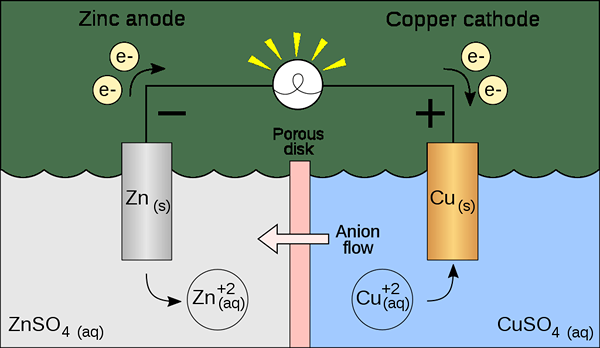
Una célula voltaica es un tipo de célula electroquímica que utiliza reacciones redox espontáneas para generar energía eléctrica. También se conoce como un célula galvánica. La célula contiene dos medias células que pueden ser de la misma composición o de diferentes composiciones. Cada media célula contiene un electrodo y un electrolito. El electrodo debe sumergirse en la solución electrolítica. A veces, estos electrolitos están completamente separados, pero otras veces, solo están separados por una barrera porosa. Cuando los electrolitos están completamente separados, necesitamos usar un puente de sal para mantener el movimiento de iones entre los dos electrolitos.

Figura 01: una celda voltaica
Al preparar esta celda, debemos considerar si los electrodos y los electrolitos son espontáneos o no. Podemos encontrarlo teóricamente calculando los potenciales de electrodo de cada media célula. Sin embargo, una media célula debería mostrar oxidación, mientras que la otra media célula debería mostrar una reacción de reducción. La oxidación ocurre en el ánodo, mientras que la reducción ocurre en el cátodo. Dado que una célula galvánica (voltaica) usa la energía liberada durante una reacción redox espontánea para generar electricidad, las células galvánicas son importantes como fuente de energía eléctrica. Producen corriente continua.
¿Qué es una célula electrolítica??
Una célula electrolítica es un dispositivo en el que la energía eléctrica se convierte en energía química o viceversa. Este tipo de célula generalmente contiene dos conductores metálicos o electrónicos que se mantienen separados entre sí y en contacto con un electrolito que generalmente se disuelve o se fusiona en compuestos iónicos.
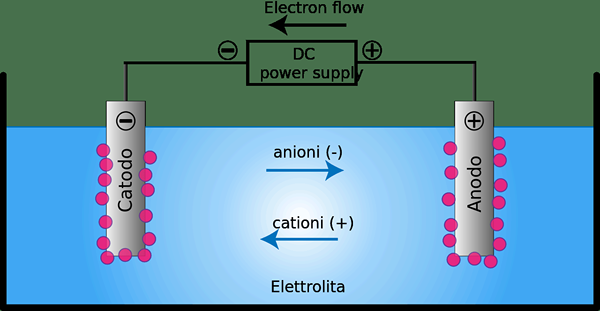
Figura 02: una celda electrolítica
Podemos usar células electrolíticas como células electroquímicas que se utilizan para hacer que la electrólisis ocurra en ciertos compuestos. Delantero.gramo. Someter el agua a la electrólisis puede formar oxígeno gaseoso e hidrógeno gaseoso. Este dispositivo utiliza una corriente eléctrica para impulsar reacciones redox termodinámicamente desfavorecidas. Además, la oxidación ocurre en el ánodo, mientras que la reducción ocurre en el cátodo.
¿Cuál es la diferencia entre la celda voltaica y la célula electrolítica??
Los términos células voltaica (célula galvánica) y células electrolíticas son muy importantes en la producción de electricidad. La diferencia clave entre la celda voltaica y la célula electrolítica es que una célula voltaica usa la energía que se libera durante una reacción redox espontánea para generar electricidad, mientras que una célula electrolítica usa la energía eléctrica de una fuente externa para forzar una reacción para forzar una reacción. Al considerar su liberación de energía, las células voltaicas obtienen energía de las reacciones redox espontáneas, mientras que las células electrolíticas involucran reacciones no espontáneas y, por lo tanto, requieren fuentes de electrones externas como baterías de CC de fuentes de alimentación de CA.
La siguiente tabla resume la diferencia entre la célula voltaica y la célula electrolítica.
Resumen -celda voltaica frente a celda electrolítica
Las células voltaicas y las células electrolíticas son dos términos importantes en electroquímica. La diferencia clave entre la célula voltaica y la célula electrolítica es que una célula voltaica usa la energía que se libera durante una reacción redox espontánea para generar electricidad, mientras que una célula electrolítica usa la energía eléctrica de una fuente externa para forzar una reacción para forzar una reacción.
Referencia:
1. "Electroquímica (artículo)." academia Khan.
Imagen de cortesía:
1. "Célula galvánica sin flujo de cationes" por original: Ohiostandard Vector: AnticompositEnumber - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. "Carga de células electrolíticas" por Rodez2 - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia


